【特集】MDNT Research Memo(9):「慢性心不全治療」は第IIbの結果により2024年9月末までに開発方針を決定
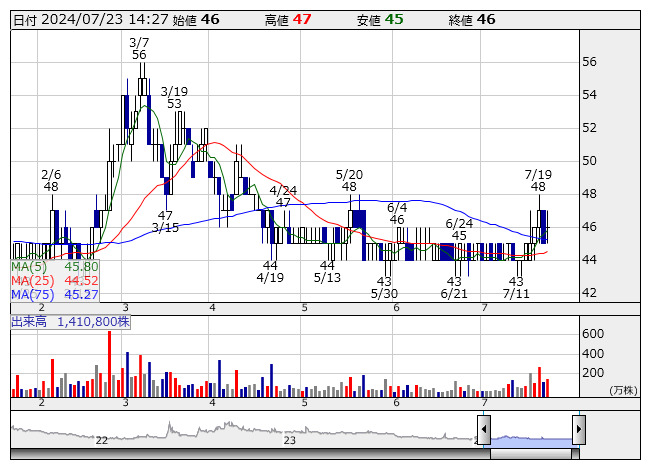 メディネット <日足> 「株探」多機能チャートより
メディネット <日足> 「株探」多機能チャートより■メディネット<2370>の事業活動の進捗及び成長戦略
2. 再生医療等製品事業の進捗と今後の取り組み
再生医療等製品事業では、製品開発段階である1) 「慢性心不全治療を目的とした再生医療等製品の実用化」(九州大学との共同研究開発)、2) 「膝軟骨損傷に用いる自家細胞培養軟骨」の2テーマを推進している。研究開発段階では、3) 「HSP105由来ペプチドに関連したがん免疫療法」(国立がん研究センターとの共同研究開発)、4) 「糖鎖修飾改変Tリンパ球(2-DGリンパ球)培養技術の応用」、5) 「先制医療※における免疫細胞治療の有用性にかかる共同研究等の研究開発」、6) 「MUSCAT-assay」(岡山大学との共同研究)と4つのテーマを進めている。このうち、1) 「慢性心不全治療を目的とした再生医療等製品の実用化」へ優先的に資源を集中している。それ以外の開発テーマについては、開発が一定程度進んだ段階で事業性評価をベースに取り組む方針である。
※先制医療とは、病気の発生を未然に防ぐことを目的に、様々な背景因子などによる予測・診断を踏まえ、症状や障害が起こる以前の段階から実施する医療のこと。
再生医療等製品事業においては、新規有望研究開発シーズの探索、国内外の企業で出口が見えている開発テーマのライセンスイン、または当該企業・研究機関との資本業務提携などといった動きが今後あるかどうかにも注目したいところである。
(1) 「慢性心不全治療を目的とした再生医療等製品の実用化」の進捗
同社と九州大学は難治性疾患である拡張型心筋症における新たな治療法として、樹状細胞を担体としたαガラクトシルセラミド(α-GalCer/DC)を用いてナチュラルキラーT細胞を活性化させることで慢性心筋炎症を制御する研究に取り組んでいる。有効性及び安全性を確認する医師主導第IIb相臨床試験(2022年1月~2024年3月)を九州大学にてスタートし、その後治験実施機関を5施設に拡大して共同試験(九州大学のほかに4大学病院施設)を実施しながら症例登録を促進した。その結果、有害事象などの影響により症例登録に遅延が生じたが、2023年9月末に予定登録症例期間満了をもって、医師主導第IIb試験の症例登録募集を終了した。目標症例数に届かなかったが、観察期間終了後、得られたデータ解析を進めている。その解析結果に基づき、2024年9月末までに開発方針を決定する。
(2) 「膝軟骨損傷に用いる自家細胞培養軟骨」の進捗
同社は2017年12月から米国Ocugen<OCGN>と自家細胞培養軟骨(米国製品名「NeoCart(R)」)の日本国内での製造・販売権契約をしている。OcugenはFDA(米国食品医薬品局)とPhaseIII試験プロトコルについての協議を開始し、自家細胞培養軟骨「NeoCart(R)」による成人の膝軟骨の修復治療に関して、FDAよりRMAT※の指定を受けたと2022年5月末に発表した。Ocugenは2024年中の治験開始に向けてFDAとプロトコル最終化に向けて協議しており、治験製品製造体制などの構築を進めている。米国でのPhaseIII試験プロトコル最終化は既に終了しており、同社はそのプロトコルを入手して、国内試験デザインについて(独)医薬品医療機器総合機構(以下、「PMDA」)と協議開始している。日本国内で研究開発については、PMDAとの協議結果並びにOcugenの治験準備状況を元に、日本における自家細胞培養軟骨の開発方針などを2024年9月末までに決定するとしている。
※RMATは再生医療のうち、重篤な状態に対する治療で、予備的な臨床的エビデンスによりアンメット医療ニーズに寄与する可能性が示唆される品目が指定の対象。RMAT指定品目は、優先審査と迅速承認の機会が与えられる。
(3) 「HSP105由来ペプチドに関連したがん免疫療法」
同社は、これまでに国立がん研究センターと「HSP-105を発現しているがんに対する免疫療法(特異的TCR-T細胞)」を共同研究してきた。国立がん研究センターでは既にHSP-105由来ぺプチドワクチンの医師主導第I相試験を実施し、HSP-105特異的TCR遺伝子を導入したTCR-T細胞の作製に成功した。2024年5月下旬には本研究に関して、HSP-105発現がん細胞に対して細胞傷害活性効果を示した特許を共同出願した。
(執筆:フィスコ客員アナリスト 清水啓司)
《SO》
提供:フィスコ

 米株
米株









